| Climat & Transferts thermiques |
L'évaporation est le passage de l'état liquide à l'état gazeux.
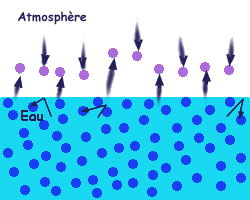 A une température moyenne
donnée, les molécules de liquide les plus
énergétiques (ayant la plus forte
énergie cinétique) et proches de la surface
passent à l'état gazeux. Et en sens inverse, les
molécules de gaz qui heurtent la surface se condensent pour
devenir des molécules liquides.
A une température moyenne
donnée, les molécules de liquide les plus
énergétiques (ayant la plus forte
énergie cinétique) et proches de la surface
passent à l'état gazeux. Et en sens inverse, les
molécules de gaz qui heurtent la surface se condensent pour
devenir des molécules liquides.
Quand il y a autant de molécules de liquide qui se transforme en gaz, que de molécules de gaz qui si transforme en liquide, il y a équilibre : on dit alors que l'air est "saturé" d'humidité. Par exemple à 20°C, il suffit d'une pression (d'un poids, d'une quantité) de 0,02 atmosphère de vapeur d'eau pour saturer l'air d'humidité. Si on chauffe à 40°C, les molécules d'eau sont plus énergétiques, il y en a plus qui passeront à l'état gazeux. L'équilibre reviendra lorsqu'il y aura plus de molécules de gaz qui passeront à l'état liquide, c'est à dire lorsque la densité ou la pression du gaz augmentera ; à 40°C, une pression de 0,07 atmosphère est nécessaire. A 80°C, une pression de 0,5 atmosphère est nécessaire. A 100°C, une pression de 1 atmosphère de vapeur d'eau est nécessaire pour redonner l'équilibre. Et à 120°C, une pression de 2 atmosphère de vapeur d'eau serait nécessaire (c'est le principe de la "cocotte-minute").
Quand il y a plus de molécules qui passent à l'état gazeux qu'à l'état liquide, il y a évaporation. C'est ainsi que l'eau de pluie, des rivières, des mers, globalement s'évapore à température ambiante (et non à 100°C) pour aller ensuite former des nuages. Rappelons bien que l'évaporisation n'est pas instantanée, et prend UN CERTAIN TEMPS...
Applications :
* Au sommet du Mont-Blanc, à 0,5 atm, une situation d'équilibre (air saturé) peut se créer jusqu'à 80°C. A une température (légèrement) supérieure, la pression de vapeur d'eau (limitée à 0,5 atm) est insuffisante pour permettre aux molécules de gaz de heurter la surface et devenir des molécules liquides ; l'équilibre est dépassé, le liquide se vaporise totalement, il bout !
* Sans atmosphère, un liquide ne peut que se vaporiser totalement (plus ou moins rapidement selon la température, et sous une gravitation usuelle) ; sans atmosphère, pas d'océan possible sur la Lune ou sur Mars. L'océan de la Terre est ainsi une conséquence de la présence de son atmosphère.